Abstract
Objective
To analyze in-hospital and 1-year morbidity and mortality associated with acute gastrointestinal dysfunction in critically ill patients with COVID-19 via a prespecified scoring system.Methods
Between March and July 2020, consecutive hospitalized patients with COVID-19 from a single institution were retrospectively analyzed by medical chart review. Only those who remained in the intensive care unit for more than 24 hours were included. Gastrointestinal dysfunction was assessed according to a predefined 5-point progressive gastrointestinal injury scoring system, considering the first 7 days of hospitalization. Laboratory data, comorbidities, the need for mechanical ventilation, the duration of intensive care unit stay, and subsequent in-hospital and 1-year mortality rates were also recorded.Results
Among 230 patients who were screened, 215 were included in the analysis. The median age was 68 years (54 - 82), and 57.7% were male. The total gastrointestinal dysfunction scores were 0 (79.1%), I (15.3%), II (4.7%), III (0.9%), and IV (0%). Any manifestation of gastrointestinal dysfunction was present in 20.9% of all patients and was associated with longer lengths of stay (20 days [11 - 33] versus 7 days [4 - 16]; p < 0.001] and higher C-reactive protein levels on admission (12.8mg/mL [6.4 - 18.4] versus 5.7mg/mL [3.2 - 13.4]; p < 0.001). The gastrointestinal dysfunction score was significantly associated with mortality (OR 2.8; 95%CI 1.7 - 4.8; p < 0.001) and the need for mechanical ventilation (OR 2.8; 95%CI 1.7 - 4.6; p < 0.001). Both in-hospital and 1-year death rates progressively increased as gastrointestinal dysfunction scores increased.Conclusion
In the current series of intensive care unit patients with COVID-19, gastrointestinal dysfunction severity, as defined by a prespecified scoring system, was predictive of adverse in-hospital and 1-year outcomes.Free full text

Prognostic significance of gastrointestinal dysfunction in critically ill patients with COVID-19
ABSTRACT
Objective:
To analyze in-hospital and 1-year morbidity and mortality associated with acute gastrointestinal dysfunction in critically ill patients with COVID-19 via a prespecified scoring system.
Methods:
Between March and July 2020, consecutive hospitalized patients with COVID-19 from a single institution were retrospectively analyzed by medical chart review. Only those who remained in the intensive care unit for more than 24 hours were included. Gastrointestinal dysfunction was assessed according to a predefined 5-point progressive gastrointestinal injury scoring system, considering the first 7 days of hospitalization. Laboratory data, comorbidities, the need for mechanical ventilation, the duration of intensive care unit stay, and subsequent in-hospital and 1-year mortality rates were also recorded.
Results:
Among 230 patients who were screened, 215 were included in the analysis. The median age was 68 years (54 - 82), and 57.7% were male. The total gastrointestinal dysfunction scores were 0 (79.1%), I (15.3%), II (4.7%), III (0.9%), and IV (0%). Any manifestation of gastrointestinal dysfunction was present in 20.9% of all patients and was associated with longer lengths of stay (20 days [11 - 33] versus 7 days [4 – 16]; p < 0.001] and higher C-reactive protein levels on admission (12.8mg/mL [6.4 - 18.4] versus 5.7mg/mL [3.2 - 13.4]; p < 0.001). The gastrointestinal dysfunction score was significantly associated with mortality (OR 2.8; 95%CI 1.7 - 4.8; p < 0.001) and the need for mechanical ventilation (OR 2.8; 95%CI 1.7 - 4.6; p < 0.001). Both in-hospital and 1-year death rates progressively increased as gastrointestinal dysfunction scores increased.
Conclusion:
In the current series of intensive care unit patients with COVID-19, gastrointestinal dysfunction severity, as defined by a prespecified scoring system, was predictive of adverse in-hospital and 1-year outcomes.
INTRODUCTION
Gastrointestinal dysfunction (GID) occurs frequently in critically ill patients and is associated with adverse outcomes. Sixty-two percent of patients admitted to intensive care units (ICUs) may exhibit one or more gastrointestinal manifestations for at least 24 hours. However, diagnosis of GID in the ICU is complex and has historically relied mostly on clinical symptoms.(1,2) With the aim of rating GID under these conditions, the acute gastrointestinal injury (AGI) grade classification was developed to assess gastrointestinal tract function in critically ill patients. Since this classification was developed descriptively, its application in clinical studies has been limited due to high interobserver variability.(3)
In this context, the GID score was created to provide a clear evaluation method that is readily available at the bedside, with minimal subjectivity and increased reproducibility. The GID grading system is fundamentally based on the AGI score but replaces the overall clinical impression of the AGI classification with detailed gastrointestinal symptoms, making it a tool for potentially predicting outcomes in hospitalized patients.(3) This study aimed to analyze the in-hospital and 1-year morbidity and mortality associated with acute gastrointestinal dysfunction in critically ill patients with coronavirus disease 2019 (COVID-19) using a predefined scoring system.
METHODS
In this single-center observational study, a consecutive sample comprising all patients with symptomatic COVID-19 admitted between March 12 and July 8, 2020, was retrospectively analyzed via medical chart review to determine the prevalence of GID. Among 230 patients who were screened and had a positive real-time reverse transcription–polymerase chain reaction (RT-PCR) test for severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2), 215 remained in the ICU for more than 24 hours and were included in the analysis.
Gastrointestinal dysfunction was assessed via a GID score previously developed by Reintam Blaser et al.(4) Patients were classified according to a 5-point progressive gastrointestinal injury scoring system: GID 0 (no risk); GID 1 (high risk); GID 2 (gastrointestinal tract dysfunction); GID 3 (gastrointestinal tract failure); and GID 4 (life-threatening dysfunction). The definitions of each level of GID are presented in table 1.
Table 1
| GID score | Definition |
|---|---|
| 0 | No symptoms or only 1 of the following factors with normal oral intake: absence of intestinal peristalsis, vomiting, gastric residual volume > 200mL, gastrointestinal paralysis or adynamic ileus, abdominal distension, nonsevere diarrhea, gastrointestinal bleeding without transfusion. |
| 1 | 2 of the following: no oral intake, absence of intestinal peristalsis, vomiting, gastric residual volume > 200mL, gastrointestinal paralysis or adynamic ileus, abdominal distension, nonsevere diarrhea, gastrointestinal bleeding without transfusion. |
| 2 | ≥ 3 symptoms of GID 1 or up to 2 of the following factors: severe diarrhea, gastrointestinal bleeding requiring transfusion. |
| 3 | ≥ 3 of the following factors: prokinetic use, gastrointestinal paralysis or adynamic ileus, abdominal distension, severe diarrhea, gastrointestinal bleeding requiring transfusion. |
| 4 | 1 of the following factors: gastrointestinal bleeding leading to hemorrhagic shock or mesenteric ischemia. |
GID - gastrointestinal dysfunction.
Strict criteria were considered for every gastrointestinal clinical manifestation. Vomiting was characterized as the occurrence of any visible regurgitation of gastric content regardless of quantity. Diarrhea was defined as ≥ 3 episodes of loose or liquid stools per day, with a total volume > 250mL, while severe diarrhea was characterized ≥ 5 episodes or a total volume ≥ 1000mL. Gastrointestinal bleeding was identified by the presence of visible blood in vomit, gastric aspirate, or stool. Adynamic ileus was defined as the absence of stool for ≥ 3 consecutive days, and intestinal obstruction was considered when its diagnosis was documented in the medical chart. These variables were recorded during the first 7 days of ICU admission and were collected by 4 previously trained physicians. In addition to the GID score, laboratory data, the presence of comorbidities, the use of invasive mechanical ventilation, the duration of ICU stay, and subsequent in-hospital and 1-year mortality rates were also documented. Survival after hospital discharge was determined by consulting a public online database of births and deaths managed by the regional judiciary system, and follow-up data available for all included patients for at least 1 year.
Stata® version 11.0 software was used for statistical analysis. Categorical variables were analyzed with Pearson's χ2 test, the Kruskal-Wallis test, and Fisher's exact test. Continuous variables are expressed as the median and interquartile range (25th to 75th percentile) and were further evaluated via the Wilcoxon-Mann-Whitney test. Clinical variables with known prognostic value and those found significant in the univariate analysis were included in a multivariate logistic regression model to identify independent predictors of in-hospital and 1-year outcomes. A p value < 0.05 was considered statistically significant.
The study conforms to the guidelines of the Declaration of Helsinki and received appropriate institutional review board approval on September 16th, 2022, under project number 5.647.896. Informed consent was not required due to the retrospective nature of the study.
RESULTS
Among 230 patients who were screened, 215 remained in the ICU for more than 24 hours and were included in the analysis. The median age of the hospitalized patients was 68 years (54 - 82) and the majority (57.7%) were male. The complete clinical and laboratory baseline characteristics are listed in table 2. The total duration of hospitalization was 9 days (5 - 21) and 21.4% of patients required mechanical ventilation. The in-hospital mortality rate was 15.8% (34 deaths), with an additional 8 deaths recorded after 1 year, resulting in a total mortality rate of 19.3%.
Table 2
| Variable | Total (n = 215) | GID score = 0 (n = 170) | GID score ≥ 1 (n = 45) | p value |
|---|---|---|---|---|
| Age (years) | 68 (54 - 82) | 67 (52 - 79) | 71 (61 - 88) | 0.002* |
| Male | 124 (57.7) | 101 (59.4) | 23 (51.1) | 0.32 |
| BMI (kg/m2) | 26.8 (23.9 - 30.1) | 26.2 (23.8 - 29.5) | 29 (25 - 31.6) | 0.08 |
| Hypertension | 113 (52.6) | 89 (52.4) | 24 (53.3) | 0.91 |
| Diabetes | 60 (27.9) | 47 (27.7) | 13 (28.9) | 0.87 |
| Cardiovascular disease | 25 (11.6) | 16 (9.4) | 9 (20) | 0.049* |
| Oxygen saturation % | 93 (91 - 95) | 94 (91 - 96) | 92 (88 - 94) | < 0.001* |
| Noninvasive ventilation | 78 (36.3) | 47 (27.7) | 31 (68.9) | < 0.001* |
| Hemoglobin (mg/dL) | 13.4 (12 - 14.6) | 13.4 (12.4 - 14.6) | 13 (11.1 - 14.4) | 0.14 |
| Leukocyte count (cells/mm3) | 5920 (4,590 - 8,300) | 5755 (4,330 - 7,860) | 7660 (5,350 - 10,480) | < 0.001* |
| C-reactive protein (mg/mL) | 6.7 (3.3 - 14.1) | 5.7 (3.2 - 13.4) | 12.8 (6.4 - 18.4) | < 0.001* |
| D-dimer (ng/mL) | 795 (465 - 1,446) | 803 (459 - 1,446) | 660 (473 - 1,366) | 0.78 |
GID - gastrointestinal dysfunction; BMI - body mass index.
The total GID scores were as follows: 0 (79.1%), I (15.3%), II (4.7%), III (0.9%), and IV (0%). Any manifestation of gastrointestinal dysfunction (GID ≥ 1) was present in 20.9% of all patients, with decreased bowel motility being the most common finding in this subgroup (53.3%), followed by diarrhea (31.1%). There were no cases of mesenteric ischemia, intestinal obstruction, or compartment syndrome. Prokinetic medications were prescribed to 34.9% of all patients and 57.8% of those with GID. Patients with GID scores ≥ 1 had higher C-reactive protein (CRP) levels at admission (12.8mg/mL [6.4 - 18.4], versus 5.7mg/mL [3.2 - 13.4]; p < 0.001), longer lengths of stay (20 days [11-33], versus 7 days [4 – 16]; p < 0.001), greater mechanical ventilation requirements (51.1% versus 13.5%; p < 0.001), and higher mortality during hospitalization (33.3% versus 11.2%; p < 0.001).
According to the univariate analysis, the overall GID score was a significant predictor of in-hospital mortality (odds ratio [OR] 2.8; 95% confidence interval [95%CI] 1.7 - 4.8; p < 0.001) and the need for mechanical ventilation (OR 2.8; 95%CI 1.7 - 4.6; p < 0.001). Both in-hospital and 1-year death rates progressively increased as GID score increased (Figure 1). The multivariate logistic model for in-hospital and 1-year outcomes included age, previous coronary artery disease, GID score, C-reactive protein level, leukocyte count, systolic blood pressure, and oxygen saturation at admission. Even after adjustment, GID remained significantly associated with the composite outcome of in-hospital death or mechanical ventilation and subsequent 1-year mortality (Tables 3 and and44).
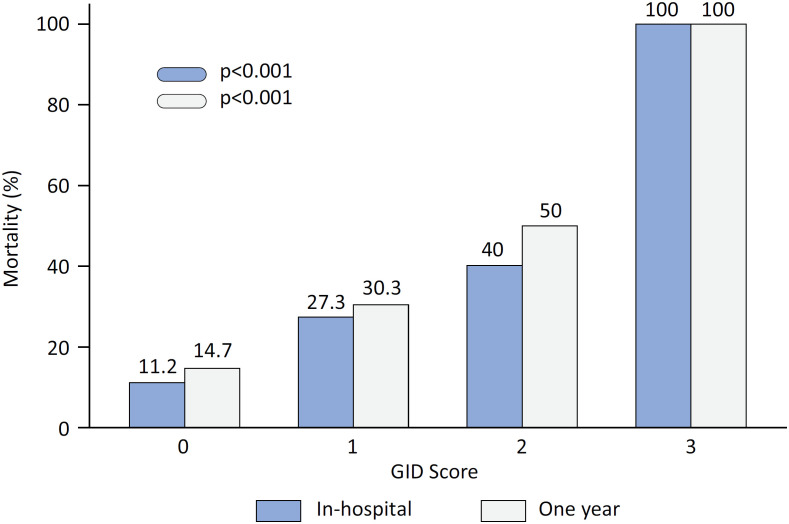
GID - gastrointestinal dysfunction.
Table 3
| Variable | Univariate analysis OR (95%CI) | p value | Multivariate analysis OR (95%CI) | p value |
|---|---|---|---|---|
| Age | 1.1 (1.0 - 1.1) | < 0.001* | 1.0 (1.0 - 1.1) | 0.002* |
| Coronary artery disease | 1.7 (0.7 - 4.1) | 0.23 | 0.8 (0.2 - 2.7) | 0.73 |
| GID Score | 4.1 (2.3 - 7.2) | < 0.001* | 3.3 (1.7 - 6.4) | < 0.001* |
| Oxygen saturation | 0.9 (0.8 - 0.9) | 0.002* | 0.9 (0.8 - 1.0) | 0.15 |
| Systolic blood pressure | 0.9 (0.9 - 1.0) | 0.009* | 0.9 (0.9 - 1.0) | 0.009* |
| C-reactive protein | 1.1 (1.1 - 1.2) | < 0.001* | 1.1 (1.0 - 1.1) | 0.014* |
| Leukocyte count | 1.1 (1.0 - 1.1) | 0.003* | 1.0 (0.9 - 1.0) | 0.87 |
OR - odds ratio; 95CI - 95% confidence interval; GID - gastrointestinal dysfunction.
Table 4
| Variable | Univariate analysis OR (95%CI) | p value | Multivariate analysis OR (95%CI) | p value |
|---|---|---|---|---|
| Age | 1.1 (1.1 - 1.2) | < 0.001* | 1.1 (1.1 - 1.2) | < 0.001* |
| Coronary artery disease | 2.1 (0.9 - 5.4) | 0.1 | 0.7 (0.2 - 2.1) | 0.48 |
| GID Score | 2.7 (1.6 - 4.5) | < 0.001* | 2.0 (1.1 - 4.0) | 0.048* |
| Oxygen saturation | 0.9 (0.8 - 0.9) | 0.01* | 0.9 (0.9 - 1.0) | 0.08 |
| Systolic blood pressure | 0.9 (0.97 - 1.0) | 0.1 | 0.9 (0.9 - 1.0) | 0.14 |
| C-reactive protein | 1.1 (1.0 - 1.1) | 0.03* | 1.0 (0.9 - 1.1) | 0.89 |
OR - odds ratio; 95CI - 95% confidence interval; GID - gastrointestinal dysfunction.
DISCUSSION
Several forms of digestive manifestations, both severe and non-severe, have been described among those with COVID-19. Data from over 18,000 patients with various clinical presentations from the early stages of the pandemic revealed that more than 30% of individuals reported gastrointestinal symptoms. Diarrhea was the most common manifestation, followed by nausea and vomiting, affecting 11.5% and 6.3% of patients, respectively.(5)
In critically ill patients hospitalized for COVID-19, higher rates of gastrointestinal complications, including mesenteric ischemia, bleeding, Ogilvie syndrome, and severe ileus, have also been reported. Even compared to other ICU patients with different illnesses, those with COVID-19 are more likely to experience gastrointestinal complications.(6) However, in other profiles of critically ill patients, these manifestations can largely be explained by a combination of adverse pharmacological events and metabolic disturbances. In the context of COVID-19, however, other factors are also involved. A greater expression of angiotensin-converting enzyme 2 receptors along the intestinal epithelial lining has been hypothesized as a possible explanation, as these receptors may facilitate the interaction between host cells and the SARS-CoV-2 virus. Additionally, virus-induced small vessel thrombosis and enteroneuropathy are other likely triggers of GID that warrant further investigation.(7)
Most importantly, such gastrointestinal compromise extends beyond the manifestation of isolated and self-limited symptoms and has been associated with adverse clinical outcomes among COVID-19 patients. A study conducted by Sun et al. aimed to investigate the outcomes of AGI in critically ill patients with COVID-19 and revealed that those with higher AGI grades also had worse clinical variables and subsequently greater in-hospital mortality.(8) These results align with the findings of the present study, as higher GID scores were independently associated with the composite outcome of death or the need for mechanical ventilation. The variables included in the multivariate model represented components of the pathophysiological triad characterizing the acute phase of severe COVID-19: hemodynamic compromise (systolic blood pressure), respiratory failure (oxygen saturation), and systemic inflammation (CRP). These findings further highlight the potential independent prognostic value of the GID score.
Our results also suggested that GID during hospitalization may be an independent predictor of mortality up to 1 year after hospitalization. In addition, various long-term gastrointestinal sequelae could arise in the postacute phase of the disease. Xu et al. evaluated over 150,000 patients who survived beyond the first 30 days of the disease and reported an increased risk of several adverse gastrointestinal outcomes in the first year of follow-up. These included motility disorders, acid-related conditions, functional intestinal disturbances, acute pancreatitis, and hepatobiliary disease. Notably, the risk of such complications was amplified among those with greater disease severity in the acute phase and was apparently minimized by prior vaccination.(9)
This study has limitations that must be acknowledged. Data were retrospectively collected from a single center and may not reflect the same results as those from other institutions. Additionally, patients were managed before evidence-based treatments and vaccines were available. The influence of currently recommended therapies for patients requiring hospitalization on gastrointestinal outcomes has been variable, with the combination of dexamethasone and remdesivir possibly having a protective effect.(10) Prognostic scoring systems applied to critically ill patients, such as the Acute Physiology and Chronic Health Evaluation II (APACHE II) or Simplified Acute Physiology Score II (SAPS II), were not used due to limited data, and the results were not adjusted for such clinical characterization.(11) Nevertheless, the variables included in the multivariate models are widely recognized as predictors of clinical severity in the context of COVID-19 and may have mitigated this limitation.(12) Finally, the number of events was low, which restricted a thorough statistical analysis of the results.
CONCLUSION
In the current series of hospitalized patients with severe COVID-19, the gastrointestinal system was frequently affected. Although symptoms were mostly mild, any manifestation of gastrointestinal dysfunction was predictive of both adverse in-hospital outcomes and 1-year mortality. Future studies should validate these findings by further implementing the gastrointestinal dysfunction score among patients with COVID-19.
Footnotes
Publisher's note
REFERENCES
Importância prognóstica da disfunção gastrintestinal em pacientes graves com COVID-19
RESUMO
Objetivo:
Analisar a morbidade e a mortalidade intra-hospitalar e em 1 ano associadas à disfunção gastrintestinal aguda em pacientes graves com COVID-19 por meio de um sistema de pontuação predefinido.
Métodos:
Entre março e julho de 2020, pacientes consecutivos hospitalizados com COVID-19 de uma única instituição foram analisados retrospectivamente por meio de revisão de prontuários médicos. Foram incluídos somente aqueles que permaneceram na unidade de terapia intensiva por mais de 24 horas. A disfunção gastrintestinal foi avaliada segundo um sistema predefinido de pontuação de lesão gastrintestinal progressiva de cinco pontos, considerando os primeiros 7 dias de hospitalização. Também se registraram os dados laboratoriais, as comorbidades, a necessidade de ventilação mecânica, a duração da internação na unidade de terapia intensiva e as taxas de mortalidade intra-hospitalar e em 1 ano.
Resultados:
Do total de 230 pacientes examinados, 215 foram incluídos na análise. A idade mediana foi de 68 anos (54 - 82), e 57,7% eram do sexo masculino. Os escores totais de disfunção gastrintestinal foram zero (79,1%), I (15,3%), II (4,7%), III (0,9%) e IV (0%). Qualquer manifestação de disfunção gastrintestinal estava presente em 20,9% de todos os pacientes e foi associada à maior duração da internação (20 dias [11 - 33] versus 7 dias [4 - 16]; p < 0,001) e a níveis mais altos de proteína C-reativa na admissão (12,8mg/mL [6,4 - 18,4] versus 5,7mg/mL [3,2 - 13,4]; p < 0,001). O escore de disfunção gastrintestinal foi significativamente associado à mortalidade (RC 2,8; IC95% 1,7 - 4,8; p < 0,001) e à necessidade de ventilação mecânica (RC 2,8; IC95% 1,7 - 4,6; p < 0,001). As taxas de mortalidade hospitalar e em 1 ano aumentaram progressivamente com o aumento dos escores de disfunção gastrintestinal.
Conclusão:
Na série atual de pacientes de unidades de terapia intensiva com COVID-19, a gravidade da disfunção gastrintestinal, conforme definida por um sistema de pontuação predefinido, foi preditiva de resultados adversos no hospital e em 1 ano.
INTRODUÇÃO
A disfunção gastrintestinal (DGI) ocorre com frequência em pacientes graves e está associada a desfechos adversos. Dos pacientes admitidos em unidades de terapia intensiva (UTIs), 62% podem apresentar uma ou mais manifestações gastrintestinais por, pelo menos, 24 horas. No entanto, o diagnóstico de DGI na UTI é complexo e, historicamente, tem sido fundamentado principalmente em sintomas clínicos.(1,2) Com o objetivo de classificar a DGI nessas condições, a classificação de grau de lesão gastrintestinal aguda foi desenvolvida para avaliar a função do trato gastrintestinal em pacientes graves. Como essa classificação foi desenvolvida de forma descritiva, sua aplicação em estudos clínicos tem sido limitada devido à alta variabilidade interobservador.(3)
Nesse contexto, o escore de DGI foi concebido para fornecer um método de avaliação claro e prontamente disponível à beira do leito, com mínima subjetividade e maior reprodutibilidade. O sistema de classificação de DGI baseia-se fundamentalmente no escore de lesão gastrintestinal aguda, mas substitui a impressão clínica geral da classificação de lesão gastrintestinal aguda por sintomas gastrintestinais detalhados, tornando-a uma ferramenta com potencial de prever desfechos em pacientes hospitalizados.(3) Este estudo objetivou analisar a morbidade e a mortalidade intra-hospitalar e em 1 ano associadas à disfunção gastrintestinal aguda em pacientes graves com a doença pelo coronavírus 2019 (COVID-19) por meio de um sistema de pontuação predefinido.
MÉTODOS
Neste estudo observacional de centro único, analisou-se retrospectivamente uma amostra consecutiva composta de todos os pacientes com COVID-19 sintomáticos admitidos entre 12 de março e 8 de julho de 2020, por meio de revisão de prontuários médicos, para determinar a prevalência de DGI. Dos 230 pacientes que foram examinados e apresentaram teste positivo de reação em cadeia da polimerase via transcriptase reversa (RT-PCR) do coronavírus da síndrome respiratória aguda grave 2 (SARS-CoV-2), 215 permaneceram na UTI por mais de 24 horas e foram incluídos na análise.
A DGI foi avaliada por meio de um escore de DGI desenvolvido anteriormente por Reintam Blaser et al.(4) Os pacientes foram classificados de acordo com um sistema de escore de DGI progressivo de 5 pontos: DGI zero (sem risco); DGI 1 (alto risco); DGI 2 (disfunção do trato gastrintestinal); DGI 3 (insuficiência do trato gastrintestinal); e DGI 4 (disfunção com risco de vida). As definições de cada nível de DGI são apresentadas na tabela 1.
Tabela 1
| Escore de DGI | Definição |
|---|---|
| 0 | Sem sintomas ou apenas um dos seguintes fatores com ingestão oral normal: ausência de peristaltismo intestinal, vômito, volume residual gástrico > 200mL, paralisia gastrintestinal ou íleo adinâmico, distensão abdominal, diarreia sem gravidade, sangramento gastrintestinal sem transfusão |
| 1 | Duas das seguintes situações: ausência de ingestão oral, ausência de peristaltismo intestinal, vômitos, volume residual gástrico > 200mL, paralisia gastrintestinal ou íleo adinâmico, distensão abdominal, diarreia sem gravidade, sangramento gastrintestinal sem transfusão |
| 2 | ≥ 3 sintomas de DGI. Um ou até dois dos seguintes fatores: diarreia grave, sangramento gastrintestinal com necessidade de transfusão |
| 3 | ≥ 3 dos seguintes fatores: uso de procinéticos, paralisia gastrintestinal ou íleo adinâmico, distensão abdominal, diarreia grave, sangramento gastrintestinal que requer transfusão |
| 4 | Um dos seguintes fatores: sangramento gastrintestinal ocasionando choque hemorrágico ou isquemia mesentérica |
DGI - disfunção gastrintestinal.
Foram considerados critérios rigorosos de cada manifestação clínica gastrintestinal. O vômito foi caracterizado como a ocorrência de qualquer regurgitação visível de conteúdo gástrico, independentemente da quantidade. A diarreia foi definida como ≥ 3 episódios de fezes soltas ou líquidas por dia, com volume total > 250mL, enquanto a diarreia grave foi caracterizada como ≥ 5 episódios ou volume total ≥ 1.000mL. O sangramento gastrintestinal foi identificado pela presença de sangue visível no vômito, no aspirado gástrico ou nas fezes. O íleo adinâmico foi definido como a ausência de fezes por ≥ 3 dias consecutivos, e a obstrução intestinal foi considerada quando seu diagnóstico foi documentado no prontuário médico. Essas variáveis foram registradas durante os primeiros 7 dias de admissão na UTI, tendo sido coletadas por quatro médicos previamente treinados. Além do escore de DGI, também foram documentados dados laboratoriais, presença de comorbidades, o uso de ventilação mecânica invasiva, a duração da internação na UTI e as taxas de mortalidade intra-hospitalar e em 1 ano. A sobrevida após a alta hospitalar foi determinada por meio de consulta a um banco de dados público on-line de nascimentos e mortes controlado pelo sistema judiciário regional e por meio de dados de seguimento obtidos de todos os pacientes incluídos por pelo menos 1 ano.
Para a análise estatística, foi utilizado o Stata®, versão 11.0. As variáveis categóricas foram analisadas pelo teste do qui-quadrado de Pearson, o teste de Kruskal-Wallis e o teste exato de Fisher. As variáveis contínuas são expressas como mediana e intervalo interquartil (IIQ25 - 75%) e foram avaliadas posteriormente por meio do teste Wilcoxon-Mann-Whitney. As variáveis clínicas com valor prognóstico conhecido e aquelas consideradas significativas na análise univariada foram incluídas em um modelo de regressão logística multivariada para identificar preditores independentes de desfechos intra-hospitalares e em 1 ano. Considerou-se estatisticamente significativo valor de p < 0,05.
O estudo está em conformidade com as diretrizes da Declaração de Helsinque e recebeu a devida aprovação do conselho de revisão institucional em 16 de setembro de 2022, sob o número de projeto 5.647.896. Não foi necessário o consentimento informado devido à natureza retrospectiva do estudo.
RESULTADOS
Dos 230 pacientes selecionados, 215 permaneceram na UTI por mais de 24 horas e foram incluídos na análise. A idade mediana dos pacientes hospitalizados foi de 68 anos (54 - 82), e a maioria (57,7%) era do sexo masculino. As características clínicas e laboratoriais basais completas estão listadas na tabela 2. A duração total da hospitalização foi de 9 dias (5 - 21), e 21,4% dos pacientes precisaram de ventilação mecânica. A taxa de mortalidade intra-hospitalar foi de 15,8% (34 mortes), com mais 8 mortes registradas após 1 ano, elevando a taxa de mortalidade total para 19,3%.
Tabela 2
| Variável | Total (n = 215) | Escore DGI = 0 (n = 170) | Escore DGI ≥ 1 (n = 45) | Valor de p |
|---|---|---|---|---|
| Idade (anos) | 68 (54 - 82) | 67 (52 - 79) | 71 (61 - 88) | 0,002* |
| Sexo masculino | 124 (57,7) | 101 (59,4) | 23 (51,1) | 0,32 |
| IMC (kg/m2) | 26,8 (23,9 - 30,1) | 26,2 (23,8 - 29,5) | 29 (25 - 31,6) | 0,08 |
| Hipertensão | 113 (52,6) | 89 (52,4) | 24 (53,3) | 0,91 |
| Diabetes | 60 (27,9) | 47 (27,7) | 13 (28,9) | 0,87 |
| Doença cardiovascular | 25 (11,6) | 16 (9,4) | 9 (20) | 0,049* |
| Saturação de oxigênio % | 93 (91 - 95) | 94 (91 - 96) | 92 (88 - 94) | < 0,001* |
| Ventilação não invasiva | 78 (36,3) | 47 (27,7) | 31 (68,9) | < 0,001* |
| Hemoglobina (mg/dL) | 13,4 (12 - 14,6) | 13,4 (12,4 - 14,6) | 13 (11,1 - 14,4) | 0,14 |
| Contagem de leucócitos (células/mm3) | 5.920 (4.590 - 8.300) | 5.755 (4.330 - 7.860) | 7.660 (5.350 - 10.480) | < 0,001* |
| Proteína C-reativa (mg/mL) | 6,7 (3,3 - 14,1) | 5,7 (3,2 - 13,4) | 12,8 (6,4 - 18,4) | < 0,001* |
| D-dímero (ng/mL) | 795 (465 - 1.446) | 803 (459 - 1.446) | 660 (473 - 1.366) | 0,78 |
DGI - escore de disfunção gastrintestinal; IMC - índice de massa corporal.
Os escores de DGI totais foram os seguintes: zero para 79,1%, I para 15,3%, II para 4,7%, III para 0,9% e IV para 0%. Qualquer manifestação de DGI ≥ 1 esteve presente em 20,9% de todos os pacientes, sendo a diminuição da motilidade intestinal o achado mais comum nesse subgrupo (53,3%), seguido de diarreia (31,1%). Não houve casos de isquemia mesentérica, obstrução intestinal ou síndrome compartimental. Prescreveram-se medicamentos procinéticos para 34,9% de todos os pacientes e 57,8% daqueles com DGI. Os pacientes com escores de DGI ≥ 1 apresentaram níveis mais altos de proteína C-reativa (PCR) na admissão (12,8mg/mL [6,4 - 18,4], versus 5,7mg/mL [3,2 - 13,4]; p < 0,001), duração mais longa da internação (20 dias [11-33], versus 7 dias [4 - 16]; p < 0,001), maior necessidade de ventilação mecânica (51,1% versus 13,5%; p < 0,001) e maior mortalidade durante a hospitalização (33,3% versus 11,2%; p < 0,001).
De acordo com a análise univariada, o escore de DGI geral foi um preditor significativo de mortalidade hospitalar (razão de chances [RC] 2,8; intervalo de confiança de 95% [IC95%] 1,7 - 4,8; p < 0,001) e da necessidade de ventilação mecânica (RC 2,8; IC95% 1,7 - 4,6; p < 0,001). As taxas de mortalidade hospitalar e em 1 ano aumentaram progressivamente, à medida que o escore de DGI aumentou (Figura 1). O modelo logístico multivariado de desfechos no hospital e em 1 ano incluiu idade, doença arterial coronariana prévia, escore de DGI, teor de proteína C-reativa, contagem de leucócitos, pressão arterial sistólica e saturação de oxigênio na admissão. Mesmo após o ajuste, a DGI permaneceu significativamente associada ao desfecho composto de morte hospitalar ou ventilação mecânica e mortalidade subsequente em 1 ano (Tabelas 3 e e44).
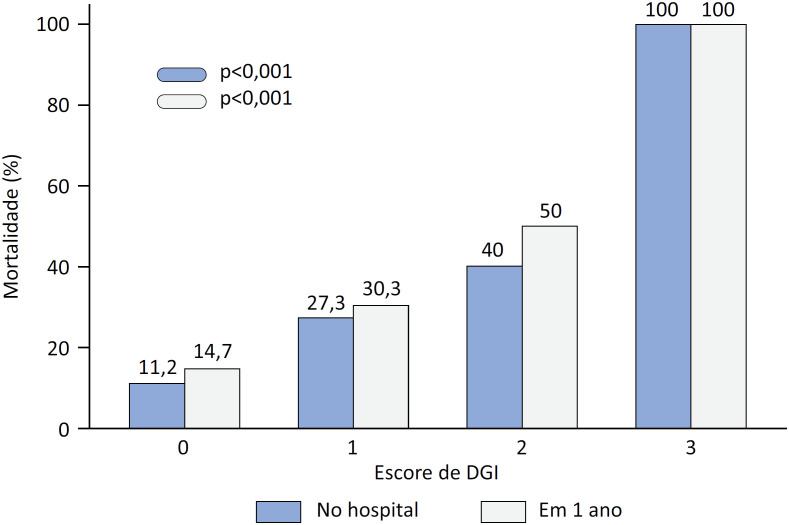
DGI - disfunção gastrintestinal.
Tabela 3
| Variável | Análise univariada RC (IC95%) | Valor de p | Análise multivariada RC (IC95%) | Valor de p |
|---|---|---|---|---|
| Idade | 1,1 (1,0 - 1,1) | < 0,001* | 1,0 (1,0 - 1,1) | 0,002* |
| Doença arterial coronariana | 1,7 (0,7 - 4,1) | 0,23 | 0,8 (0,2 - 2,7) | 0,73 |
| Escore de DGI | 4,1 (2,3 - 7,2) | < 0,001* | 3,3 (1,7 - 6,4) | < 0,001* |
| Saturação de oxigênio | 0,9 (0,8 - 0,9) | 0,002* | 0,9 (0,8 - 1,0) | 0,15 |
| Pressão arterial sistólica | 0,9 (0,9 - 1,0) | 0,009* | 0,9 (0,9 - 1,0) | 0,009* |
| Proteína C-reativa | 1,1 (1,1 - 1,2) | < 0,001* | 1,1 (1,0 - 1,1) | 0,014* |
| Contagem de leucócitos | 1,1 (1,0 - 1,1) | 0,003* | 1,0 (0,9 - 1,0) | 0,87 |
RC - razão de chances; IC95% - intervalo de confiança de 95%; DGI - disfunção gastrintestinal.
Tabela 4
| Variável | Análise univariada RC (IC95%) | Valor de p | Análise multivariada RC (IC95%) | Valor de p |
|---|---|---|---|---|
| Idade | 1,1 (1,1 - 1,2) | < 0,001* | 1,1 (1,1 - 1,2) | < 0,001* |
| Doença arterial coronariana | 2,1 (0,9 - 5,4) | 0,1 | 0,7 (0,2 - 2,1) | 0,48 |
| Escore de DGI | 2,7 (1,6 - 4,5) | < 0,001* | 2,0 (1,1 - 4,0) | 0,048* |
| Saturação de oxigênio | 0,9 (0,8 - 0,9) | 0,01* | 0,9 (0,9 - 1,0) | 0,08 |
| Pressão arterial sistólica | 0,9 (0,97 - 1,0) | 0,1 | 0,9 (0,9 - 1,0) | 0,14 |
| Proteína C-reativa | 1,1 (1,0 - 1,1) | 0,03* | 1,0 (0,9 - 1,1) | 0,89 |
RC - razão de chances; IC95% - intervalo de confiança de 95%; DGI - disfunção gastrintestinal.
DISCUSSÃO
Várias formas de manifestações digestivas, tanto graves quanto não graves, foram descritas entre as pessoas com COVID-19. Dados de mais de 18 mil pacientes com várias apresentações clínicas dos estágios iniciais da pandemia revelaram que mais de 30% dos indivíduos relataram sintomas gastrintestinais. A diarreia foi a manifestação mais comum, seguida de náuseas e vômitos, afetando 11,5 e 6,3% dos pacientes, respectivamente.(5)
Em pacientes graves hospitalizados por COVID-19, também foram relatadas taxas mais altas de complicações gastrintestinais, incluindo isquemia mesentérica, sangramento, síndrome de Ogilvie e íleo grave. Mesmo em comparação com outros pacientes de UTI com diferentes doenças, aqueles com COVID-19 têm maior probabilidade de apresentar complicações gastrintestinais.(6) No entanto, em outros perfis de pacientes graves, essas manifestações podem ser amplamente explicadas por uma combinação de eventos farmacológicos adversos e distúrbios metabólicos. No contexto da COVID-19, no entanto, outros fatores também estão envolvidos. Uma maior expressão de receptores da enzima conversora de angiotensina 2 ao longo do revestimento epitelial intestinal foi considerada uma possível explicação, já que esses receptores podem facilitar a interação entre as células hospedeiras e o SARS-CoV-2. Além disso, a trombose de pequenos vasos induzida pelo vírus e a enteroneuropatia são outros prováveis fatores desencadeantes da DGI que justificam uma investigação mais aprofundada.(7)
Mais importante ainda, esse comprometimento gastrintestinal vai além da manifestação de sintomas isolados e autolimitados e tem sido associado a desfechos clínicos adversos entre pacientes com COVID-19. Um estudo conduzido por Sun et al. teve como objetivo investigar os desfechos de lesão gastrintestinal aguda em pacientes graves com COVID-19 e revelou que aqueles com graus mais altos desse tipo de lesão também tinham variáveis clínicas desfavoráveis e, subsequentemente, maior mortalidade hospitalar.(8) Esses resultados se alinham com os achados do presente estudo, pois escores de DGI mais altos foram independentemente associados ao desfecho composto de morte ou necessidade de ventilação mecânica. As variáveis incluídas no modelo multivariado representaram componentes da tríade fisiopatológica que caracteriza a fase aguda da COVID-19 grave: comprometimento hemodinâmico (pressão arterial sistólica), insuficiência respiratória (saturação de oxigênio) e inflamação sistêmica (PCR). Esses achados destacam ainda mais o potencial valor prognóstico independente do escore de DGI.
Nossos resultados também sugeriram que a DGI durante a hospitalização pode ser um preditor independente de mortalidade até 1 ano após a hospitalização. Além disso, várias sequelas gastrintestinais duradouras podem surgir na fase pós-aguda da doença. Xu et al. avaliaram mais de 150 mil pacientes que sobreviveram após os primeiros 30 dias da doença e relataram risco maior de vários desfechos gastrintestinais adversos no primeiro ano de seguimento. Esses desfechos incluíram distúrbios de motilidade, condições relacionadas à acidez, distúrbios intestinais funcionais, pancreatite aguda e doença hepatobiliar. Notavelmente, o risco de tais complicações foi ampliado entre aqueles com maior gravidade da doença na fase aguda e foi aparentemente minimizado pela vacinação prévia.(9)
Este estudo tem limitações que devem ser reconhecidas. Os dados foram coletados retrospectivamente em um único centro e podem não refletir os mesmos resultados que os de outras instituições. Além disso, os pacientes foram tratados antes da disponibilidade dos tratamentos baseados em evidências e das vacinas. A influência das terapias atualmente recomendadas para pacientes que necessitam de hospitalização nos desfechos gastrintestinais tem sido variável, sendo que a combinação de dexametasona e remdesivir pode ter um efeito protetor.(10) Os sistemas de pontuação prognóstica aplicados a pacientes graves, como o Acute Physiology and Chronic Health Evaluation II (APACHE II) ou o Simplified Acute Physiology Score II (SAPS II), não foram utilizados devido à limitação de dados, e os resultados não foram ajustados para essa caracterização clínica.(11) No entanto, as variáveis incluídas nos modelos multivariados são amplamente reconhecidas como preditores de gravidade clínica no contexto da COVID-19 e podem ter atenuado essa limitação.(12) Por fim, o número de eventos foi baixo, o que restringiu uma análise estatística completa dos resultados.
CONCLUSÃO
Na série atual de pacientes hospitalizados com COVID-19 grave, o sistema gastrintestinal foi frequentemente afetado. Embora os sintomas tenham sido em sua maioria leves, qualquer manifestação de disfunção gastrintestinal foi preditiva de desfechos adversos no hospital e de mortalidade em 1 ano. Estudos futuros devem validar esses achados implementando ainda mais o escore de disfunção gastrintestinal em pacientes com COVID-19.
Footnotes
Notas de publicação
Articles from Critical Care Science are provided here courtesy of Associação de Medicina Intensiva Brasileira



