Saltsyre er en sterk syre som lages ved å løse gassen hydrogenklorid i vann. Det er denne syren som finnes i magesaften i magesekken. Den kjemiske formelen er HCl.
Faktaboks
- Også kjent som
- acidum hydrochloricum, acidum muriaticum
Saltsyre er en sterk syre som lages ved å løse gassen hydrogenklorid i vann. Det er denne syren som finnes i magesaften i magesekken. Den kjemiske formelen er HCl.
Saltsyre er ikke-oksiderende. Når den omsettes i handelen, kan den inneholde forskjellig mengde hydrogenklorid avhengig av bruken. Konsentrert saltsyre har en stikkende lukt, ryker i fuktig luft, og kalles derfor rykende saltsyre (se bilde). Den inneholder 37 vektprosent HCl og har en tetthet på 1,19 gram per milliliter. Røyken kommer av at syren avgir hydrogenklorid, som med fuktigheten i luften danner dråper av saltsyre.
Kjemisk ren saltsyre er en fargeløs, vannklar væske. Teknisk saltsyre kan være gulfarget på grunn av forurensninger, hovedsakelig av jern(III)-ioner.
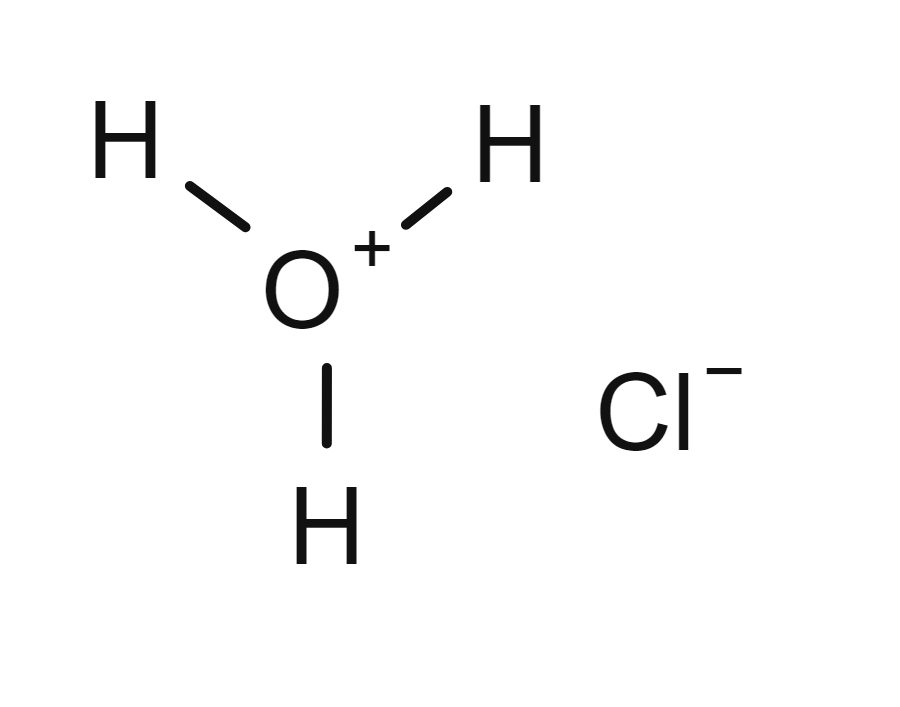
Saltsyre er fullstendig protolysert:
HCl(g) + H2O(aq) → H3O+(aq) + Cl−(aq)
Saltsyrens salter kalles klorider. I naturen kan saltsyre forekomme i gasser fra en vulkan.

37 prosent saltsyre.
Saltsyre blir brukt i kjemilaboratorier for analytiske og preparative formål.
I industrien er saltsyre mye brukt, blant annet i petroleums- og plastindustrien, til aktivering av oljekilder, ved opparbeidelse av malmer for fremstilling av metaller og etsing av metaller, for galvaniske formål, i fotografisk og grafisk industri, for rensing og etsing av metaller, fremstilling av klorider, klorkalk og lignende, til fjerning av kjelstein, atskilling av fettsyrer fra såpevann, regenerasjon av ionebyttere, dybdeboringer i kalkfjell, ved fargestoffsynteser, i næringsmiddelindustrien, i landbruket til konservering av grøntfôr med mer.
Trolig hadde allerede de tidligste alkymistene kjennskap til saltsyre. Hydrogenklorid kan ha blitt fremstilt av Basilius Valentinus på 1400-tallet, men ble med sikkerhet fremstilt i gassform for første gang i 1772 av Joseph Priestley.
Saltsyre fremstilles fra salt (NaCl) og konsentrert svovelsyre (H2SO4):
2NaCl(s) + H2SO4(aq) → Na2SO4 (s) + 2HCl(aq)
Den første som fremstilte saltsyre på denne måten, var Johann Rudolph Glauber. Industriell fremstilling av saltsyre etter denne metoden begynte i Storbritannia fra 1863.
I dag fremstilles hydrogenklorid også ved direkte reaksjon mellom hydrogen og klor:
H2(g) + Cl2(g) → 2HCl(g)
eller som biprodukt ved klorering av hydrokarboner.
Innånding av saltsyredamp kan føre til lungebetennelse, og til slutt blir lungeblærene angrepet, slik at blod trenger inn i lungehulrommene.
Saltsyre som kommer på huden, trenger inn gjennom hudporene og gir røde flekker, blærer og brennende smerter.
Konsentrert saltsyre fremkaller smertefulle etsninger i hals, spiserør og mage, senere også heshet, åndenød, hjertesvakhet og besvimelsesanfall, ofte med dødelig utgang.
Grenseverdi for saltsyregass i arbeidsmiljøet er 7 milligram HCl per kubikkmeter luft.
Saltsyre er sterkt etsende på alle typer vev. Svelging kan gir perforasjon eller striktur (forsnevring). Den viktigste førstehjelpen ved eksponering for etsende syre er umiddelbar og grundig skylling med vann.

Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.